 |
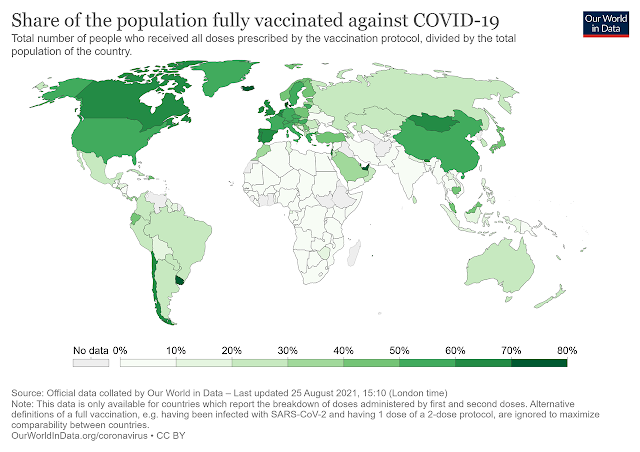
| Proportion de la population mondiale vaccinée contre la COVID-19; en date du 25 août 2021. Source: https://en.wikipedia.org/wiki/COVID-19_vaccine |
Les pénuries d'approvisionnement en vaccins COVID-19 suscitent des inquiétudes quant à l'immunité compromise dans certains pays, du fait de l’allongement de l'intervalle entre la première et la deuxième dose. A l'inverse, les pays sans contraintes d'approvisionnement envisagent d'administrer une troisième dose. Nous avons évalué la persistance de l'immunogénicité après une dose unique de ChAdOx1 nCoV-19 (AZD1222), l'immunité après un intervalle prolongé (44 à 45 semaines) entre la première et la deuxième dose et la réponse à une troisième dose en tant que rappel administré 28 à 38 semaines après la deuxième dose.
Dans cette sous-étude, des volontaires âgés de 18 à 55 ans inscrits dans l'essai contrôlé de phase 1/2 (COV001) au Royaume-Uni et ayant reçu une dose unique ou deux doses de 5 × 1010 particules virales ont été invités à revenir pour la vaccination. Nous rapportons ici la réactogénicité et l'immunogénicité d'une deuxième dose retardée (44 à 45 semaines après la première dose) ou d'une troisième dose du vaccin (28 à 38 semaines après la deuxième dose). Des données provenant de volontaires âgés de 18 à 55 ans qui ont été inclus dans les essais contrôlés randomisés en simple aveugle de phase 1/2 (COV001) ou de phase 2/3 (COV002) de ChAdOx1 nCoV-19 et qui avaient déjà reçu une dose unique ou deux doses de 5 x 1010 particules virales sont utilisées à des fins de comparaison. Les deux essais COV001 et COV002 sont toujours en cours.(…).
Entre le 11 et le 21 mars 2021, 90 participants ont été inscrits dans la sous-étude de rappel de la troisième dose, dont 80 (89 %) étaient évaluables pour la réactogénicité, 75 (83 %) étaient évaluables pour l'évaluation des anticorps et 15 (17 %) étaient évaluables pour les réponses des lymphocytes T. La cohorte à deux doses comprenait 321 participants qui avaient des données de réactogénicité (avec un intervalle d'amorçage de 8 à 12 semaines : 267 [83 %] sur 321 ; 15 à 25 semaines : 24 [7 %] ; ou 44 à 45 semaines : 30 [9 %]) et 261 qui avaient des données d'immunogénicité (intervalle de 8 à 12 semaines : 115 [44 %] sur 261 ; 15 à 25 semaines : 116 [44 %] ; et 44 à 45 semaines : 30 [11 %]) . L'immunogénicité de 480 participants de la cohorte à dose unique a pu être évaluée jusqu'à 44 à 45 semaines après la vaccination. Les titres d'anticorps après une dose unique mesurés environ 320 jours après la vaccination sont restés supérieurs aux titres mesurés au départ (titre moyen géométrique de 66,00 unités ELISA [UEs ; Intervalle Confiance -IC- à 95 % 47,83–91,08] vs 1,75 UEs [ 1,60-1,93]). 32 participants ont reçu une deuxième dose tardive du vaccin 44 à 45 semaines après la première dose, dont 30 ont été inclus dans les analyses d'immunogénicité et de réactogénicité. Les titres d'anticorps étaient plus élevés 28 jours après la vaccination chez ceux avec un intervalle plus long entre la première et la deuxième dose que pour ceux avec un intervalle court (titre médian d'IgG totales : 923 UE [Intervalle Interquartile -IQR- 525–1764] avec un intervalle de 8 à 12 semaines ; 1860 UE [917-4934] avec un intervalle de 15-25 semaines ; et 3738 UE [1824-6625] avec un intervalle de 44-45 semaines). Parmi les participants qui ont reçu une troisième dose de vaccin, les titres d'anticorps (mesurés chez 73 [81 %] participants pour lesquels des échantillons étaient disponibles) étaient significativement plus élevés 28 jours après une troisième dose (titre médian d'IgG totales : 3746 UE [IQR 2047-6420] ) que 28 jours après une deuxième dose (médiane 1792 UE [IQR 899–4634] ; test des rangs signés de Wilcoxon p = 0,0043). Les réponses des lymphocytes T ont également été amplifiées après une troisième dose (la réponse médiane est passée de 200 unités formatrices de taches [SFU] par million de cellules mononucléées du sang périphérique [PBMC ; IQR 127-389] immédiatement avant la troisième dose à 399 SFU par million de PBMC [314 –662] au jour 28 après la troisième dose ; test des rangs signés de Wilcoxon p = 0,012). La réactogénicité après une deuxième dose tardive ou une troisième dose était inférieure à la réactogénicité après une première dose.
Un intervalle prolongé avant la deuxième dose de ChAdOx1 nCoV-19 entraîne une augmentation des titres d'anticorps. Une troisième dose de ChAdOx1 nCoV-19 induit des anticorps à un niveau qui correspond à une efficacité élevée après la deuxième dose et stimule les réponses des lymphocytes T. Ami Flaxman, DPhil, et al, dans The Lancet, publication en ligne en avant-première, 1er septembre 2021
Financement: UK Research and Innovation, Engineering and Physical Sciences Research Council, National Institute for Health Research, Coalition for Epidemic Preparedness Innovations, National Institute for Health Research Oxford Biomedical Research Centre, Chinese Academy of Medical Sciences Innovation Fund for Medical Science, Thames Valley, South Midlands NIHR Clinical Research Network, AstraZeneca, Wellcome.
Source: The Lancet Online
/ Préparation post: NZ
Aucun commentaire:
Enregistrer un commentaire