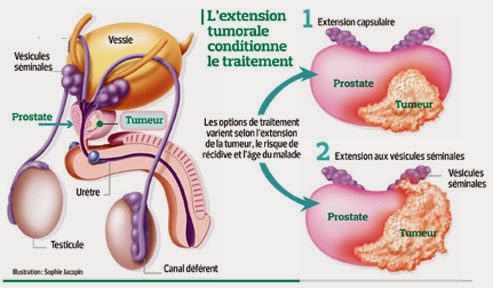
|
Prostate et vésicules séminales normales.
Source iconographique et légendaire:https://fr.wikipedia.org/wiki/Cancer_de_la_prostate |
La durée optimale de la
privation androgénique associée à une radiothérapie à haute dose dans le cancer
de la prostate reste controversée. L'essai DART 01/05 a été conçu pour
déterminer si la privation androgénique à long terme est supérieure à la
privation androgénique à court terme lorsqu'elle est associée à une
radiothérapie à haute dose. Les résultats à 5 ans ont montré que 2 ans de privation
androgénique adjuvante associée à une radiothérapie à haute dose amélioraient
significativement le contrôle biochimique, les métastases et la survie globale,
en particulier chez les patients atteints d'une maladie à haut risque. Dans ce
rapport, nous présentons les résultats finaux de l'essai sur 10 ans.
Cet essai ouvert, de phase
3, randomisé et contrôlé a été réalisé dans dix hôpitaux en Espagne. Les
critères d'éligibilité incluaient les patients âgés de 18 ans ou plus atteints
d'un adénocarcinome de la prostate histologiquement confirmé de stade clinique
T1c à T3, N0 et M0, selon la classification de 2002 de l'American Joint
Committee on Cancer, avec des facteurs de risque intermédiaire et de risque
élevé, un taux d’antigène spécifique de la prostate (PSA) inférieur à 100
ng/mL, et un score de performance de Karnofsky d'au moins 70 %. Les patients
ont été randomisés (1:1) pour recevoir 4 mois de traitement néoadjuvant et
concomitant de privation androgénique à court terme (STAD) plus une
radiothérapie à haute dose (dose minimale 76 Gy ; dose médiane 78 Gy) ou pour
recevoir le même traitement suivi de 24 mois de privation androgénique à long
terme (DLTA) adjuvante, via un programme de randomisation généré par le
logiciel d'analyse statistique (version 9.1) et un système de réponse Web
interactif. Les patients assignés au groupe STAD ont reçu 4 mois de privation
androgénique néoadjuvante et concomitante (flutamide oral 750 mg par jour ou
bicalutamide oral 50 mg par jour) avec de la goséréline sous-cutanée (2 mois
avant et 2 mois en association avec une radiothérapie à forte dose). Un
traitement anti-androgène a été ajouté au cours des 2 premiers mois de
traitement. Les patients assignés au DLTA ont continué avec la goséréline tous
les 3 mois pendant 24 mois supplémentaires. Le critère principal était la
survie sans maladie biochimique à 5 ans. Pour cette étude de 10 ans, nous avons
analysé la survie globale, la survie sans métastase, la survie sans maladie
biochimique et la survie par cause. L'analyse a été faite dans le but de
traiter. Cet essai est clos. (…).
Entre le 7 novembre 2005 et
le 20 décembre 2010, 355 patients ont été recrutés. Un patient du groupe STAD
s'est retiré de l'essai, donc 354 participants ont été assignés au hasard au
groupe STAD (n = 177) ou au groupe DLTA (n = 177). Le suivi médian était de
119·4 mois (Intervalle Interquartile [IQR] 100,6–124,3). La survie sans maladie
biochimique à 10 ans pour le groupe DLTA était de 70,2 % (Intervalle de
Confiance [IC] à 95 % 63,1–77,3) ; et pour le groupe STAD, elle était de
62,3 % (54,9–69,7 ; risque relatif [HR] 0,84 ; IC à 95 % 0,50–1,43 ; p = 0,52).
À 10 ans, la survie globale était de 78,4 % (72,1–84,8) pour le DLTA et de 73,3
% (66,6–80,0) pour le groupe STAD (HR 0,84 ; IC à 95 % 0,55 –1,27 ; p=0,40), et
la survie sans métastase était de 76,0 % (69,4–82,7) pour le groupe DLTA et de
70,9 % (64,0–77,8) pour le groupe STAD (HR 0,90 ; IC à 95 %, 0,37–2,19 ; p = 0,81).
Pour le sous-groupe de patients à haut risque, la survie sans maladie
biochimique à 10 ans était de 67,2 % (57,2–77,2) pour le groupe DLTA et de 53,7
% (43,3–64,1) pour le groupe STAD (HR 0,90 ; IC 95 % 0,49–1,64 ; p=0·73) ;
la survie globale à 10 ans était de 78,5 % (69,6–87,3) pour le groupe DLTA et
de 67,0 % (57,3–76,7) pour le groupe STAD (HR 0,58 ; IC 95 % 0,33–1,01 ; p=0·054) ;
et la survie sans métastase à 10 ans était de 76,6 % (IC 95 % 67,6–85,6) pour
le DLTA et 65,0 % (55,1–74,8) pour le STAD (HR 0,89 ; IC 95 % 0,33–2,43 ; p=0,82).
Seuls 11 (3%) des 354 patients sont décédés du cancer de la prostate, tous dans
le sous-groupe à haut risque (cinq dans le groupe DLTA et six dans le groupe
STAD). 76 (21%) patients sont décédés d'autres causes (principalement des
seconds cancers chez 31 [9%] patients et des maladies cardiovasculaires chez 21
patients [6%]). Aucun décès lié au traitement n'a été observé.
Après un suivi prolongé de
10 ans, nous n'avons pas été en mesure de soutenir le bénéfice significatif du
protocole DLTA rapporté à 5 ans. Cependant, l'ampleur du bénéfice était
cliniquement pertinente chez les patients à haut risque. Les patients à risque
intermédiaire traités par radiothérapie à haute dose ne bénéficient pas du
DLTA. Une caractérisation biologique avec l'inclusion de tests génomiques est
nécessaire dans le processus de prise de décision. Almuneda Zapatero, PhD, et
al, dans The Lancet Oncology, publication en ligne en avant-première, 12 avril
2022
Financement : Groupe de Recherche en Oncologie
Radiothérapique et Société Espagnole d’Oncologie Radiothérapique, Agence d’Etat
de la Recherche, Astra Zeneca
Source : The
Lancet Online / Préparation post : NZ