 |
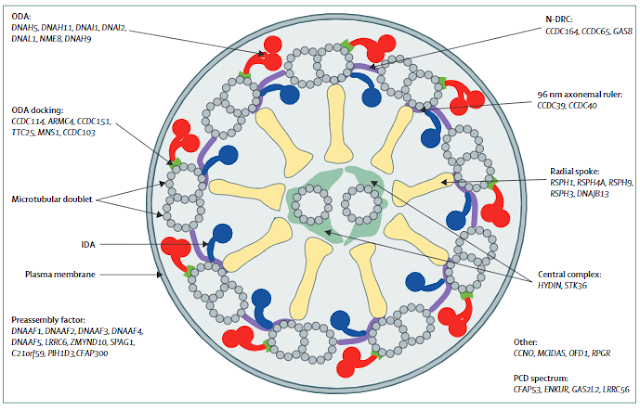
Ensemble des gènes en cause dans la dyskinésie ciliaire primitive
Cette figure montre l’axonème
et résume et présente les gènes (plus de 40 en tout) qui sont associés à la
dyskiinésie cliliaire primitive en affectant les protéines ciliaires, leur
transport, ou l’ancrage de leur structure. ODA=bras de dynéine externe. CP=paire
centrale de microtubules ou microtubules uniques. N-DRC=complexe de régulation
nexine-dynéine. PCD=dyskinésie ciliaire primaire.
|
La dyskinésie primaire primitive est un syndrome
génétiquement et cliniquement hétérogène. Une perte de motilité des cils provoque
une défaillance du mécanisme d’épuration mucociliaire. Les patients présentent
le plus souvent une détresse respiratoire néonatale de cause indéfinie et
continuent d’être atteints par une toux grasse quotidienne, des infections respiratoires
récidivantes, des rhinosinusites pérennes, des otites moyennes avec effusion,
et bronchiectasie. Approximativement 50% des patients sont atteints de situs
inversus, et sont souvent infertiles. Alors que la compréhension de la génétique
sous-jacente et des mécanismes de la maladie ont beaucoup évolué au cours des années
récentes, les éléments de preuve permettant un traitement restent manquants.
Les techniques de séquençage de dernière génération ont accéléré le rythme des
découvertes en matière de génomique, et les mutations dans plus de 40 gènes ont
été identifiés comme la cause de la dyskinésie ciliaire primaire, avec beaucoup
d’autres gènes en passe d’être découverts. Une connaissance améliorée des gènes
ciliaires reste le défi à relever pour une perception meilleure du phénotype
clinique ; de fait, certains gènes identifiés au cours des cinq dernières
années sont associés à une maladie respiratoire bénigne. Les développements en génomique
et médecine moléculaire améliorent rapidement les méthodes de diagnostic, et la
dyskinésie ciliaire primitive est imputable à un défaut génique chez environ
70% des patients à ce jour.
Des groupes de recherches sont en cours d’investigation
de traitements nouveaux et personnalisés; toutefois, les thérapies géniques ne
seront vraisemblablement pas disponibles dans un avenir proche. Prof Jane S
Lucas, MD, et al, dans The Lancet Respiratory Medicine, publication en ligne en
avant-première, 14 octobre 2019
Source iconographique, légendaire et rédactionnelle :
The Lancet Online / Traduction et
adaptation : NZ


