|
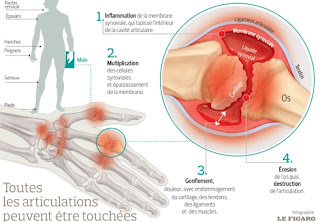
Rheumatoid Arthritis = Polyarthrite Rhumatoïde
Healthy Joint = Articulation Saine
Cartilage = Cartilage
Bone Erosion = Erosion de l'Os
Swollen Inflamed Synovial Membrane = Membrane Synoviale Enflée et Enflammée
Cartilage wears away = Le Cartilage s'use
Reduced joint space = Réduction de l'espace inter-articulaire
Source iconographique: https://commons.wikimedia.org/wiki/File:Rheumatoid-Arthritis.png |
L’upadacitinib, un inhibiteur sélectif de la Janus
Kinase 1 (JAk)1, a montré une efficacité en combinaison avec un (ou des)
médicament(s) antirhumatismal(aux) modificateur(s) de la maladie conventionnels
(csDMARDs) chez des patients atteints de polyarthrite rhumatoïde ayant présenté
une réponse indadéquate aux DMARDs. Notre but était d’évaluer l’innocuité et l’efficacité
du passage d’une thérapie méthotrexate à monothérapie upadacitinib versus
maintien d’un thérapie méthotrexate chez des patients présentant une réponse inadéquate
au méthotrexate.
L’essai SELECT-MONOTHERAPY a été réalisé dans 138 sites
situés dans 24 pays. Pour ce faire, des adultes (âge ≥18 ans) satisfaisant aux
critères de classement de l’American College of Rheumatology (ACR) – European League
Against Rheumatism (EULAR) 2010. Les patients atteints de polyarthrite rhumatoïde
active bien que recevant des doses stables de méthotrexate, ont été répartis au
hasard (2 :2 :1 :1) pour passer à monothérapie à prise
quotidienne unique d’upadacitinib ou pour
continuer le traitement au méthotrextate (…) ; à partir de la semaine 14,
les patients désignés pour continuer le traitement au méthotrexate ont reçu 15
mg ou 30 mg d’upadacitinib quotidiennement selon la répartition définie par allocation
aléatoire à la ligne de base. Les critères principaux dans cette étude étaient la
proportion de patients obtenant une amélioration de 20% selon les critères ACR (ACR20)
à la semaine 14, et la proportion de patients
obtenant un "score d’activité de la maladie faible" défini comme un Score d’Activité
de la Maladie sur 28 Articulations par mesure de la protéine C-réactive (DAS28[CRP]),
inférieur ou égal à 3.2; pour l'évaluation des deux scores définis ci-dessus, il était tenu compte des non-répondants à la
semaine 14. Les paramètres ont été évalués chez tous les patients qui avaient
reçu au moins une dose du médicament à l’étude. La présente étude est toujours
en cours ; le recrutement de patients nouveaux en est toutefois clos.
Les patients ont été sélectionnés entre le 23
février 2016 et le 19 mai 2017 ; 648 ont été alloués aux groupes de
traitement. 598 (92%) patients ont participé à l’étude jusqu’à la semaine 14. A
la semaine 14, une réponse ACR20 était obtenue par 89 (41%) patients sur 216
(Intervalle de Confiance [IC] 95% 35-48) dans le groupe continuant le traitement
au méthotrexate, par 147 (68%) patients sur 217 (62-74) recevant l’upadacitinib
15 mg, et 153 (71%) patients sur 215 (65-77) recevant l’upadacitinib 30 mg
(p<0.0001 pour les deux doses versus
continuation du traitement méthotrexate).
Un score DAS28 (CRP) de 3.2 ou moins était obtenu
chez 42 (19%) patients sur 216 (IC 95% 14-25) dans le groupe continuation du
traitement méthotrexate, par 97 (45%) patients sur 217 (38-51) recevant
upadacitinib 15 mg, et 114 (53%) patients sur 215 (46-60) recevant upadacitinib
30 mg (p<0.0001 pour les deux doses versus
continuation du traitement métothrexate).
Les événements indésirables ont été rapportés par 102
patients (47%) sous continuation du traitement méthorexate, 103 (47%) patients
sous upadacitinib 15 mg, et par 105 (49%) patients sous upadacitinib 30 mg. Un
Herpes zoster était rapporté par un patient (<1%) sous continuation du
traitement méthotrexate, trois (1%) sous
upadacitinib 15 mg, et six (3%) sous upadacitnib 30mg. Trois malignités (une
[<1%] sous continuation du traitement au méthotrexate, deux [1%] sous upadacitinib
15 mg), trois événements cardiovasculaires graves signalés (un [<1%] sous
upadacitnib 15 mg, deux [1%] sous upadacitinib 30 mg), une embolie pulmonaire
signalée (<1% ; upadacitnib 15 mg), et un décès (<1% ;
upadacitinib 15 mg, rupture d’anévrisme) ont également été rapportés dans cette étude.
La monothérapie upadacitinib a montré des
améliorations statistiquement significatives sur le plan clinique versus
continuation du traitement sous méthtrexate dans cette population ne répondant
pas de façon adéquate au méthotrexate. Les observations relatives à l’innocuité
des traitements se sont révélées similaires à celles observées dans de précédentes
études d’évaluation de l’upadacitinib administré chez des patients souffrant de
polyarthrite rhumatoïde. Prof Josef S Smolen, FRCP, et al, dans The Lancet,
publication en ligne en avant-première, 23 mai 2019
Financement : Abbvie Inc, USA