Source iconographique, légendaire et rédactionnelle : Science Direct / Préparation post :
NZ
Jusqu'au 30 juin 2022, le blog Actualités Scientifiques - Médicales vous a proposé des traductions en français adaptées de résumés d'articles originaux, tout récemment parus et relayés sur site internet. Actualités Scientifiques - Médicales. A partir du 1er septembre 2022, ce blog vous propose des billets d'opinion relatifs à l'actualité scientifique et médicale, selon un rythme qui reste à définir.
vendredi 3 septembre 2021
#trendsincellbiology #matrisome #nichemétastatique Un pépin dans la matrice : des matrisomes spécifiques d'organes dans des niches métastatiques
lundi 3 mai 2021
#Cell #régulationgénique #cellulesimmunes #maladieimmunitaire Paysage dynamique de la régulation génique spécifique des cellules immunitaires dans les maladies à médiation immunitaire
Des études génétiques ont révélé que beaucoup de variants génétiques sont associés à des maladies à médiation immunitaire. Afin d’élucider les éléments déclencheurs de ces maladies, il est essentiel de comprendre la fonctionnalité de ces variants, plus spécialement dans des conditions pathologiques. Dans le cas présent, nous avons réalisé une analyse à grande échelle d’expression génique des cellules avec l’analyse simultanée de la séquence de leur génome entier. Notre jeu de donnée consistant en 28 types d’échantillons de cellules immunitaires provenant de 337 patients diagnostiqués de 10 catégories différentes de maladies à médiation immunitaire et de 79 volontaires sains. Notre jeu de données a recueilli des profils d’expression génique distincts dans l’ensemble des types de cellules et de maladies étudiés. L’analyse de l’expression des caractères associés aux loci quantitatifs (eQTL) a révélé des variations dynamiques des effets de l’expression eQTL selon les contextes de conditions immunologiques, et selon les de types cellulaires. Ces eQTLs type cellulaire-dépendants et contexte-dépendants ont montré un enrichissement significatif en variants génétiques associés aux maladies à médiation immunitaire, impliquant à la fois les types cellulaires, les gènes et l’environnement associés aux maladies. Cet atlas approfondit notre compréhension des fonctions immunogénétiques des variants génétiques associés aux maladies, dans des conditions pathologiques in vivo. Mineto Ota, et al, dans Cell, publication en ligne en avant-première, 1er mai 2021
Source iconographique, légendaire et rédactionnelle : Science Direct / Traduction et
adaptation : NZ
mercredi 30 septembre 2020
#Cell #crohn #microbioteintestinal #tissuadipeux Translocation du Microbiote Intestinal Viable vers le Tissu Adipeux Mésentérique Entraîne la Formation de Graisse Rampante chez les Humains
 |
| Healthu ileum = Iléon sain Crohn's disease ileum = Iléon atteint par la maladie de Crohn Mesenteric adipose = Tissu adipeux mésentérique Creeping fat = Graisse rampante |
Une caractéristique mystérieuse de la maladie de Crohn (CD) est la présence extra-intestinale de « graisse rampante » (CrF) ; il s’agit de l’expansion du tissu adipeux mésentérique autour d’un intestin fibreux enflammé. Dans la présente étude, nous cherchons à définir si la translocation microbienne dans le cas d’une CD représente un indice de développement de la CrF. Nous avons découvert une échantillon bactérien associé à la muqueuse intestinale qui est transloqué en permanence, tout en restant viable dans la CrF présente dans la résection de CD iléale ; et avons identifié Clostridium innocuum comme signature de ce regroupement, avec des variations selon les souches observées entre les prélèvements muqueux et adipeux, suggérant une préférence pour les milieux riches en lipides. Le séquençage ARN sur cellule unique a permis de caractériser la CrF comme pro-fibrotique et pro-adipogénique avec un milieu riche en cellules immunes répondant aux stimuli microbiens, ce que nous confirmons chez la souris gnotobiotique colonisée avec C. innocuum. La validation ex vivo de ces profils d’expression suggère que C. innocuum stimule le remodelage tissulaire via les macrophages M2, menant à un tissu adipeux jouant un rôle barrière contre la dissémination systémique des bactéries. Connie W.Y. Ha, et al, dans Cell, publication en ligne en avant-première, 28 septembre 2020
Source iconographique, légendaire et rédactionnelle :
Science Direct / Traduction et
adaptation : NZ
jeudi 7 novembre 2019
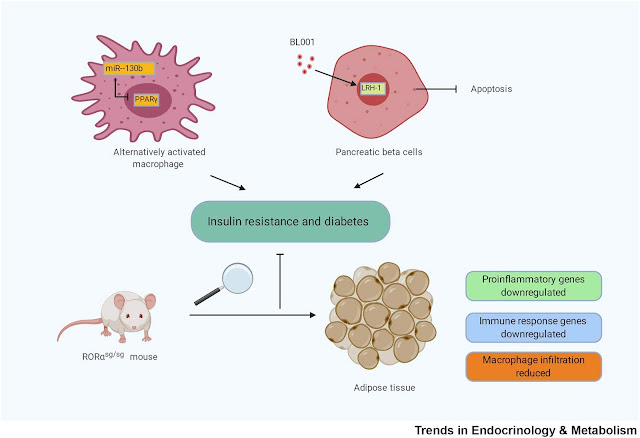
#trendsinendocrinologyandmetabolism #récepteurnucléaire #immunorégulation Fonctions Immunorégulatrices des Récepteurs Nucléaires : Mécanismes et Implications Thérapeutiques
*Il est possible d'augmenter la définition de l'image ci-dessus en cliquant dessus (note de l'éditeur de ce post).
vendredi 13 juillet 2012
Cellules immunitaires résidentes du tissu adipeux: acteurs clés dans l'immuno-métabolisme
 |
| Des chercheurs du CNRS de l'Université Paul Sabatier à Toulouse ont mis en évidence, dans le tissu adipeux, l'existence de cellules souches similaires à celles de la moëlle osseuse. Ces cellules sont capables de se différencier en mastocytes, des cellules immunitaires impliquées notamment dans les processus allergiques, et la réponse à une inflammation. Source iconographique et légendaire: http://www.i-professionnel.com/actualite-tissu-adipeux-produit-cellules-impliquees-reponse-immunitaire-17734.html |