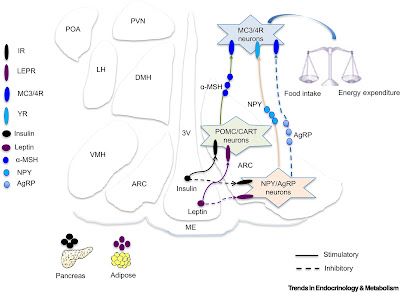
Le récepteur à mélanocortine 4 (MC4R), un élément
de la voie de signalisation leptine-mélanocortine, joue un rôle dans la
régulation du poids corporel. Les obésités sévères précoces peuvent être
causées par de variants bialléliques de gènes affectant la voie de
signalisation MC4R. Nous rapportons les résultats d’essais visant à évaluer les
effets de l’agoniste de MC4R setmelanotide chez des sujets atteints d’obésité
sévère due à une déficience en pro-opiomélanocortine (POMC) ou une obésité due
à une déficience en récepteur à la leptine (LEPR).
Ces essais multicentriques de phase 3 à simple
bras, ouverts, ont été réalisés dans 10 hôpitaux situés au Canada, aux USA, en
Belgique, France, Allemagne, au Pays-Bas, et au Royaume-Uni. Les participants,
âgés de 6 ans ou plus, atteints d’obésité due à une déficience en POMC ou LEPR,
ont reçu la setmelanotide en ouvert, pendant 12 semaines. Les participants, présentant
une perte de poids d’au moins 5 kg (ou ≥ 5% si leur poids corporel < 100 kg
à la ligne de base) intégraient une séquence de retrait du médicament de 8
semaines contrôlée par placebo (comprenant notamment 4 semaines d’administration
de setmelanotide ou du placebo en aveugle) ; suivi de 32 semaines
additionnelles de traitement en ouvert. Le critère principal de cette étude,
évalué chez les participants qui avaient reçu au moins une dose du médicament à
l’étude et qui pouvaient justifier d’une évaluation à la ligne de base (ensemble
d’analyse intégral), était la proportion de participants présentant une perte
de poids corporel d’au moins 10% en comparaison du poids corporel à la ligne de
base à 1 ans. Un critère secondaire clé était le pourcentage moyen de
changement du score le plus élevé de niveau de faim selon l’échelle de Likert comprenant
11 niveaux au cours d’approximativement un an de traitement ; évalué sur
un échantillon de participants âgés de 12 ans et plus dans l’ensemble d’analyse
intégral qui présentaient une perte de poids corporel d’au moins 5 kg (ou ≥
5% chez les participants pédiatriques si leur poids corporel à la ligne de base
était < 100 kg) sur la période de traitement en ouvert de 12 semaines et qui
étaient ensuite intégrés à la séquence de retrait du médicament, indépendamment
de la suite donnée à leur participation. (…).
Entre le 14 février 2017 et le 7 septembre 2018, dix
sujets ont été recrutés pour participer à l’essai POMC et 11 sujets ont été
recrutés pour participer à l’essai LEPR, et inclus dans l’ensemble d’analyse
intégral et les groupes d’analyse de l’innocuité. Huit sujets (80%) participant
à l’essai POMC et cinq sujets (45%) participant à l’essai LEPR ont obtenu une perte de
poids corporel d’au moins 10% à un an. Le pourcentage moyen du changement du
score du niveau de faim le plus élevé était de -27.1% (n=7 ; Intervalle de
Confiance [IC] 90% de -40.6 à -15.0% ; p=0.0005) dans l’essai POMC
et de -43.7% (n=7 ; de -54.8 à -29.1 ; p<0.0001) dans
l’essai LEPR. Les événements indésirables les plus communément relevés étaient
réactions au niveau du site d’injection et hyperpigmentation, rapportés chez
les 10 participants à l’essai POMC ; des nausées étant rapportées chez
cinq participants et des vomissements chez trois participant à cet essai. Dans l’essai
LEPR, les événements indésirables liés au traitement les plus fréquemment
rapportés étaient réaction au niveau du site d’injection chez les 11
participants, troubles cutanés chez cinq participants, et nausées chez quatre
participants à cet essai. Aucun événement indésirable grave lié au traitement n’est
survenu, ni dans l’essai POMC, ni dans l’essai LEPR.
Nos résultats soutiennent la setmelanotide comme
traitement contre l’obésité et l’hyperphagie causée par une déficience en POMC
ou LEPR. Prof Karine Clément, MD, et al, dans The Lancet Diabetes &
Endocrinology, publication en ligne en avant-première, 30 octobre 2020
Financement : Rythm Pharmaceuticals.
Source : The Lancet Online / Traduction et
adaptation : NZ